Реферат: по химии ученицы 9 класса «б»
Содержание:
Человек в мире веществ
Код ОГЭ по химии: 5.3. Человек в мире веществ, материалов и химических реакций
В повседневной жизни мы постоянно сталкиваемся с химическими веществами и химическими реакциями.
Лекарства
Каждая семья хранит и использует необходимые ей для здоровья лекарства.
Пероксид водорода (H2O2) — отличный антисептик. Это 1—2 %-ный раствор пероксида, который иногда путают с пергидролем (30 % H2O2) и получают тяжелые ожоги.
Нашатырный спирт (водный раствор аммиака NH3). Им пользуются, чтобы вывести больного из состояния обморока, так как его запах возбуждает дыхательный центр.
Аспирин — один из препаратов, который используется как жаропонижающее, противовоспалительное, болеутоляющее. Аспирин — это органическая кислота, он сдерживает свертывание крови.
Лекарства для лечения сердечно-сосудистой системы — это валидол, корвалол, нитроглицерин. Последнее средство снимает спазмы сосудов сердца. Есть в аптечке средства для лечения пищеварительной системы. Наиболее популярными компонентом таких лекарств является салол (сложный эфир салициловой кислоты), который в щелочной среде желудка гидролизуется и подавляет деятельность чужеродных микроорганизмов. Такие же свойства и у фталазола и сульгина.
Имеются и более сильные препараты для борьбы с микроорганизмами, это антибиотики пенициллина, их без рецепта не продают.
В аптечке часто находятся витамины. Это не лекарства, а хорошее средство для укрепления организма.
Моющие и чистящие средства
Мы широко используем в быту различные моющие средства
С мылом учащиеся уже знакомились в разделе «Жиры», а сейчас обратим внимание на синтетические моющие средства (СМС). Основой СМС являются поверхностно-активные вещества, в которых длинный углеводородный предельный (неразветвленный) радикал (как в мыле) соединен с сульфатной группой
Их производство основано на продуктах переработки нефти. СМС действуют в жесткой и холодной воде, и их расход меньше, чем мыла.
В состав стиральных порошков входят отбеливатели, придающие тканям белизну и яркость. Действующим началом химических отбеливателей служат атомарный кислород (O), атомарный хлор (Cl) и оксид серы (IV) (SO2). Следует избегать отбеливать одновременно большие количества белья и проветривать помещение, т. к. образуются ядовитые газы — хлор (Cl2) и оксид серы (IV) (SO2) (продукт разложения NaHSO3). Для смягчения воды при стирке с СМС добавляют метафосфат натрия (NaPO3)n, соду (NaCO3) и силикат натрия (NaSiO3).
Основу чистящих средств составляют абразивы. Это молотая пемза (природный материал вулканическая лава), каолин (минерал Al2O3 • 2SiO3 • 2H2O), наждачный порошок (корунд Al2O3, оксид хрома Cr2O3), мел (CaCO3).
Моющие и чистящие вещества тщательно смывают водой в конце работы.
Химические средства гигиены и косметики
Зубные пасты. Важнейшим средством гигиены являются зубные пасты. Основные компоненты таких паст следующие: абразивные, связующие, пенообразующие вещества, загустители. В качестве абразива применяют химически осажденный карбонат кальция CaCO3, а также фосфаты кальция CaHPO4, Ca3(PO4)2, Ca2P2O7 и полимерный метафосфат натрия (NaPO3)n. Для превращения смеси абразивов в пасту применяют органические вещества из морских водорослей и производных целлюлозы. Получение пластичной массы обеспечивают добавки глицерина, сорбита, полиэтиленгликоля. Антисептики (формальдегид, хлорированные фенолы) устраняют разрушительное действие микробов. Приятный вкус и запах создают вкусовые компоненты (сахарин, гвоздичное масло) и отдушки (ментол, мятые масла).
Дезодоранты. Они бывают двух видов. Одни тормозят разложение выводимых с потом продуктов метаболизма, другие подавляют выделение пота. Этим свойством обладают соли алюминия, цинка, циркония, хрома, железа, а также формальдегид и этиловый спирт. Эти вещества взаимодействуют с компонентами пота, образуя нерастворимые соединения, которые закрывают каналы потовых желез.
Косметика. В тональных кремах применяется оксид цинка (ZnO). В качестве пигмента губных помад применяют органическое соединение никеля. Перламутровый эффект создают соли висмута BiOCl, BiONO3 или слюда с добавками оксида титана (IV) (TiO2). Лаки для ногтей представляют собой раствор нитроцеллюлозы в органических растворителях.
Важнейшим косметическим средством для лица являются пудры. Это многокомпонентные смеси. В них входят: тальк (3MgO • 4SiO2 • H2O), каолин (2Al2O3 • 4SiO2 • 4H2O), стеараты цинка Zn(C17H35COO) и магния Mg(C17H35COO), рисовый крахмал, оксиды цинка и титана (ZnO, TiO), пигмент Fe2O3.
Конспект урока «Человек в мире веществ».
Следующая тема: «».
Антибиотики
Антибиотики – это химические вещества, образуемые микроорганизмами, которые
обладают способностью подавлять рост или даже разрушать бактерии и другие
микроорганизмы. Это определение дано С. Ваксманом.
Однако З. В. Ермольева
дает более широкое толкование этому понятию: “Антибиотики – вещества природного
происхождения, обладающие выраженной биологической активностью. Они могут быть
получены из микробов, растительных и животных тканей, синтетическим путем”.
Микробиологические
основы химиотерапии инфекционных заболеваний.
Каждый антибиотик
обладает специфическим избирательным действием на определенные виды микробов.
Благодаря такому избирательному действию многие антибиотики способны подавлять
жизнедеятельность патогенных микроорганизмов в безвредных для организма
концентрациях. Такие антибиотики широко используют для лечения различных
инфекционных болезней.
Основными продуцентами
антибиотиков служат микроорганизмы, обитающие в почве и воде, где они постоянно
вступают между собой в самые разнообразные взаимоотношения. Последние могут
быть нейтральными, взаимовыгодными (например, деятельность гнилостных бактерий
создает условия для деятельности нитрифицирующих бактерий), но очень часто они
являются антагонистическими. И это понятно. Только таким путем в природе могло
сложиться сбалансированное сосуществование громадного числа видов живых
существ. И. И. Мечников предложил использовать антагонизм между бактериями на
пользу человеку. Он, в частности, рекомендовал подавлять активность гнилостных
бактерий в кишечнике человека, продукты жизнедеятельности которых, по его
мнению, сокращают жизнь человека, молочнокислыми бактериями.
Механизмы микробного
антагонизма различны. Они могут быть связаны с конкуренцией за кислород и
питательные вещества, с изменением рН среды в сторону, неблагоприятную для
конкурента, и т.д.
Одним из универсальных
механизмов микробного антагонизма является синтез химических веществ-антибиотиков,
которые либо подавляют рост и размножение других видов микроорганизмов
(бактериостатическое действие), либо убивают их (бактерицидное действие).
Требования,
предъявляемые к антибиотикам.
Чтобы быть хорошим
лечебным средством, антибиотик должен иметь, по крайней мере, некоторые
обязательные свойства.
1.
При низкой концентрации (10-30 мкг /мл) он должен
убивать возбудителя болезни или подавлять его рост и размножение.
2.
Активность антибиотика не должна существенно
снижаться под действием жидкостей организма.
3.
Он должен быстро воздействовать на микроорганизм,
чтобы за короткий срок прервать его жизненный цикл.
4.
Антибиотик не должен вредить макроорганизму.
Аллергенность и токсичность и после введения разовой дозы, и после
многократного введения должны отсутствовать.
5.
Антибиотик не должен препятствовать процессу
выздоровления.
6.
Антибиотик не должен снижать и тем более подавлять
иммунологические реакции. Он не должен наносить никакого ущерба иммунной
системе организма.
Хотя, здесь есть и
исключения. Речь идет о поиске таких антибиотиков, которые бы подавляли
трансплантационный иммунитет. К числу последних относится циклоспорин А,
который обладает мощным иммуносупрессивным действием. Однако его широкому применению
препятствует цитотоксическое действие на почки.
Основные группы
антибиотиков.
Антибиотики имеют
различное химическое строение. Нашедшие применение в медицине антибиотики
относятся к нескольким группам:
1.
b-лактамные
антибиотики;
2.
тетрациклиновые антибиотики;
3.
стрептомициновые антибиотики;
4.
аминогликозиды;
5.
микролидные антибиотики;
6.
рифамициновые антибиотики;
7.
противогрибковые антибиотики;
8.
левомицетиновые антибиотики.
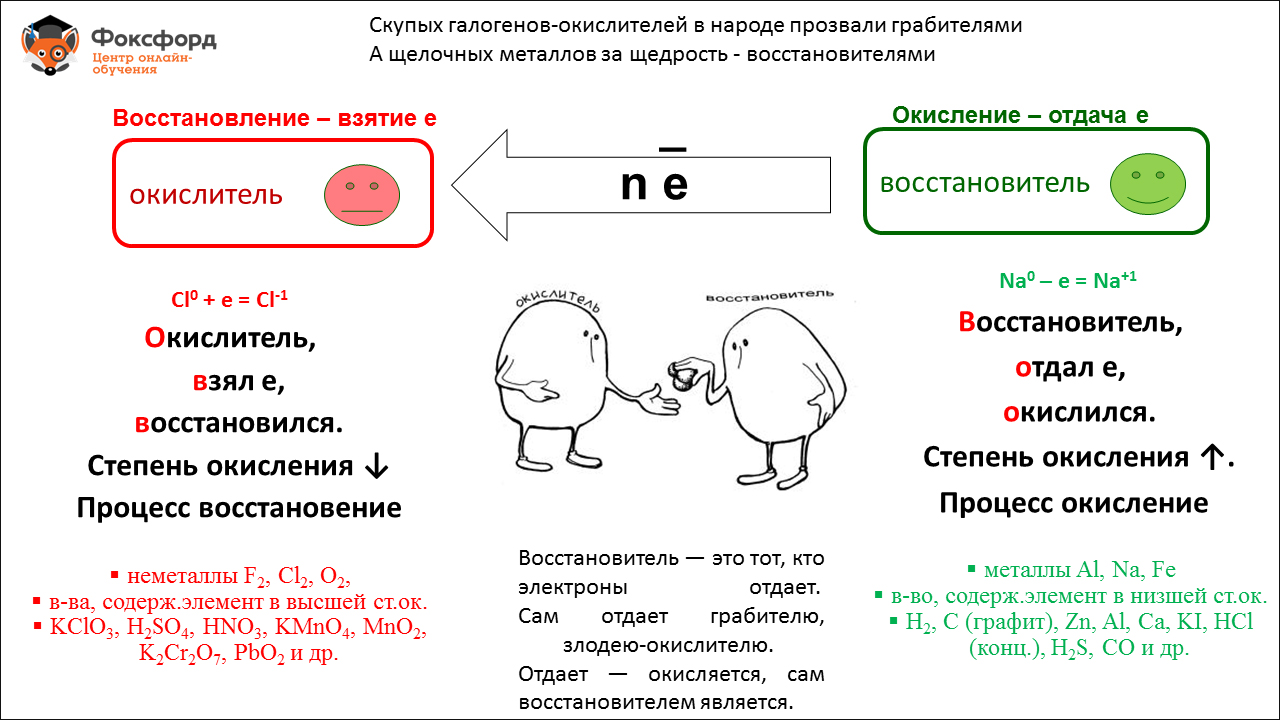
Кислоты
Кислоты представляют собой химически сложные вещества, молекулы которых состоят из кислотного остатка и атомов Н водорода (одного или нескольких). Недаром слова «кислый» и «кислота» — однокоренные: по своим вкусовым качествам все кислоты имеют кислый привкус, что совсем не означает, что кислотные составы можно пробовать. Среди них, большая половина — едкие, а остальные даже токсичные. Есть, конечно, и исключения – уксусная, лимонная, яблочная, аскорбиновая и щавелевая, которые знакомы каждому с детства, и их успешно используют в пищевой промышленности.
Какого бы происхождения ни была кислота (природного или синтетического), она всегда в своей структуре будет иметь определенное количество атомов водорода, которые могут вступать в реакционные соединения. В ходе химической реакции каждая молекула кислоты будет отдавать атомы водорода, а взамен будет принимать атомы различных металлов. Так происходит замещение.
Кислоты принято классифицировать по двум признакам:
1. или есть атомы кислорода в молекуле,2. по количеству водородных атомов, которые способны замещаться на атомы металлов.
Первая группа, в свою очередь, имеет две подгруппы:
- бескислородные кислоты (фтороводородная кислота HF, соляная HCl, бромоводородная HBr, иодоводородная HI, сероводородная H2S).- кислородосодержащие кислоты (серная H2SO4, сернистая H2SO3, фосфорная H3PO4, угольная H2CO3, азотная HNO3, кремниевая H2SiO3).
Вторая группа тоже имеет несколько подгрупп:
- одноосновные кислоты (имеют 1 атом водорода),- двухосновные кислоты (имеют 2 атома водорода),- трехосновные кислоты (имеют 3 атома водорода).
Химические свойства кислот описываются следующими правилами:
1. Кислоты взаимодействуют с основаниями, образуя соль, которая всегда будет содержать неизменный кислотный остаток. Эта реакция получила название нейтрализации. Второй продукт, образующийся в ходе протекания реакции нейтрализации, это – вода.
Чтобы нейтрализация состоялась, требуется выполнить следующее условие: хотя бы один из компонентов должен хорошо растворяться в воде. А так как кислоты отлично соответствуют этому параметру, они могут взаимодействовать как с нерастворимыми, так и с растворимыми основаниями. Исключение – кремниевая кислота, которая практически не растворяется в воде, поэтому может вступать в реакцию только с растворимыми основаниями (KOH, NaOH).
2. Растворы кислот действуют на индикаторы (специальные вещества), изменяя их окраску в воде. Кислоты изменяют цветовую окраску индикатора в один определенный цвет, поэтому всегда можно точно определить, что в составе вещества присутствует кислота. Так, лакмус и оранжевый метиловый станут красными.
Индикаторы – вещества довольно сложного строения. В основаниях и нейтральных растворах они будут совсем другого цвета, чем в кислотной среде.
3. Кислоты реагируют с металлами при выполнении такого условия:
- металл по шкале активности должен быть максимально реакционноспособным. Так серебро, золото и медь с кислотой реагировать не будут, а цинк, кальций и натрий, наоборот, будут взаимодействовать очень активно. Причем будет выделяться много газов водорода и большое количество тепла.
Некоторые металлы будут вступать в реакцию только с разбавленными кислотами. Если же кислоты концентрированные (безводные), то никакого замещения не произойдет.